Enhertu para el cáncer de pulmón: ¿Dónde está aprobado y cómo conseguirlo?
Última actualización: 15 de julio de 2024
Puede acceder legalmente a nuevos medicamentos, aunque no estén aprobados en su país.
Más informaciónEnhertu fam-trastuzumab deruxtecan-nxki) ha sido uno de los tratamientos oncológicos a seguir, desde su primera aprobación por la FDA en 2019 1.
Aunque aún se está investigando la seguridad y eficacia de Enhertu en el cáncer de ovario y el cáncer colorrectal, el medicamento ya está aprobado para varias indicaciones. Entre ellas, el cáncer de mama HER2-positivo, el cáncer gástrico HER2-positivo y el cáncer de mama HER2-bajo. La FDA también aprobó Enhertu para el cáncer de pulmón no microcítico HER2 mutante. En Europa, el CHMP ha emitido recientemente un dictamen positivo para hacer lo mismo en la UE 2.
Si usted es un paciente con cáncer de pulmón en el Reino Unido o en cualquier otro lugar fuera de los EE.UU. y la UE, probablemente se esté preguntando cuándo estará también disponible Enhertu para usted.
Esto es todo lo que hay que saber sobre Enhertu para el cáncer de pulmón, y lo que pueden esperar los pacientes del Reino Unido y del resto del mundo.
¿Cuál es la indicación de Enhertu para el cáncer de pulmón?
Como terapia dirigida, Enhertu sólo está indicado para tratar cánceres con mutación HER2. Como tal, el tratamiento se aplica a aproximadamente el 2% de todos los pacientes con CPNM 3.
Enhertu está indicado como monoterapia en pacientes adultos con CPNM avanzado cuyos tumores presentan una mutación activadora de HER2 (ERBB2). Enhertu está dirigido a pacientes que han recibido un tratamiento sistémico previo y cuyo cáncer se ha extendido a otras partes del cuerpo o no puede extirparse quirúrgicamente 2.
¿Cuál es la tasa de éxito de Enhertu en el cáncer de pulmón?
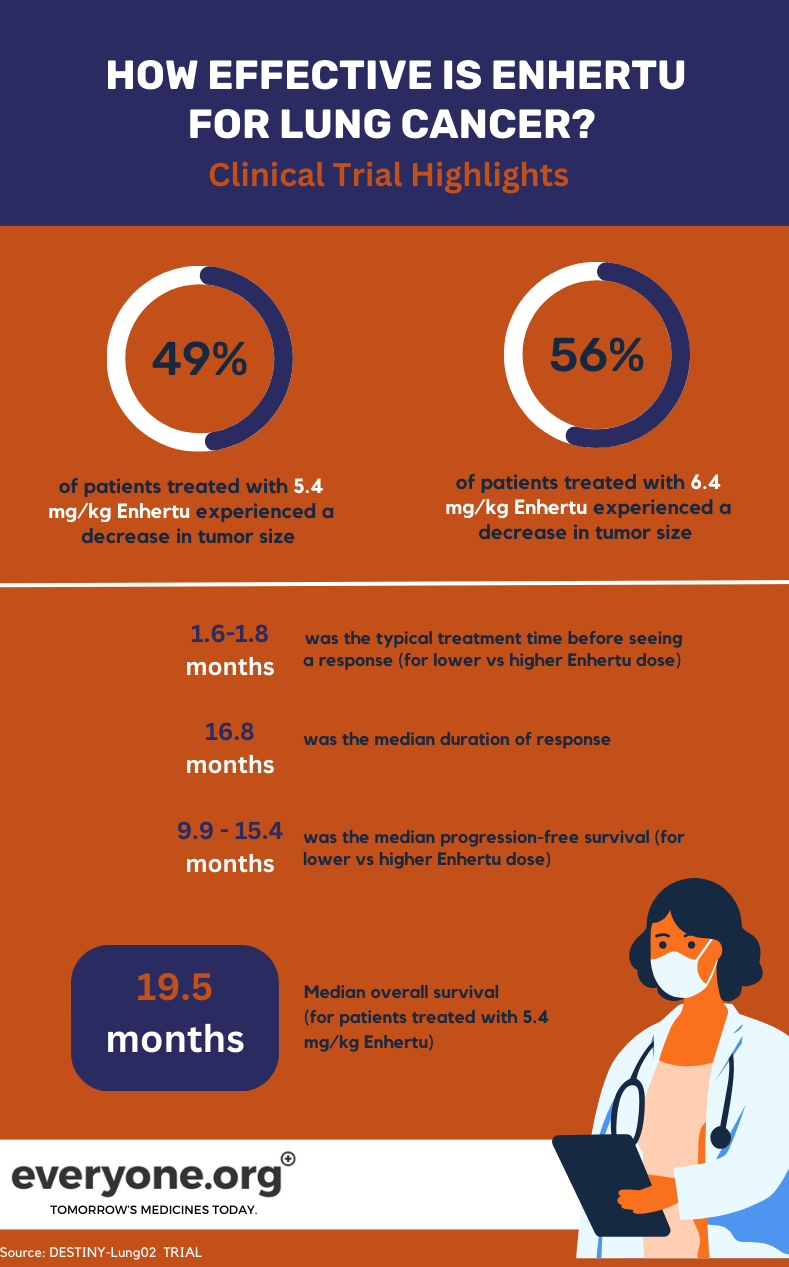
El ensayo de fase II DESTINY-Lung02, actualmente en curso, investiga la seguridad y eficacia de Enhertu en el tratamiento del CPNM con mutación HER2. En el ensayo se están comparando dos dosis de Enhertu (5,4 mg/kg y 6,4 mg/kg).
Para los pacientes con cáncer de pulmón, los principales resultados preliminares del ensayo DESTINY-Lung02 son:
- Los tumores se redujeron en el 49% de los pacientes tratados con la dosis más baja Enhertu y en el 56% de los tratados con la dosis más alta.
- Los tumores desaparecieron por completo en el 1% y el 4% de los pacientes del grupo de dosis más baja y más alta, respectivamente.
- La mediana de la duración de la respuesta fue de 16,8 meses para los pacientes del grupo de dosis más bajas Enhertu . Para los pacientes del otro grupo, la DoR se notificó como no estimable.
- La mediana del tiempo necesario para observar la respuesta inicial al tratamiento fue de 1,8 meses y 1,6 meses en el grupo de dosis más baja y más alta, respectivamente.
- La mediana de supervivencia libre de progresión fue de 9,9 meses con 5,4 mg/kg, y de 15,4 meses con 6,4 mg/kg 4.
¿Cuál fue la mediana de supervivencia de los pacientes Enhertu ?
Para los pacientes que recibieron la dosis más baja Enhertu en el ensayo clínico, la mediana de supervivencia global (SG) fue de 19,5 meses. La SG se notificó como no estimable para el grupo de dosis más alta 4.
¿Cuáles son los efectos secundarios de Enhertu en los pulmones?
Se han notificado algunos casos graves, potencialmente mortales o mortales de enfermedad pulmonar intersticial (EPI) en pacientes Enhertu . Los pacientes con insuficiencia renal moderada pueden presentar un mayor riesgo 6.
En el ensayo DESTINY-Lung02, se notificó EPI en el 12,9% de los pacientes del grupo de dosis más bajas, y en el 28% de los pacientes del grupo de dosis más altas. La mayoría de estos casos no fueron graves. Se notificó EPI de grado 3 o superior en el 2% de los pacientes de ambos grupos.
El perfil de seguridad de Enhertu para el cáncer de pulmón es similar a su rendimiento en otras indicaciones. Basándose en la menor incidencia de efectos adversos (38,6% frente a 58%), la dosis de 5,4 mg/kg se considera el tratamiento óptimo para pacientes con CPNM 4.

¿Dónde está aprobado Enhertu para el cáncer de pulmón?
Actualmente, Enhertu está aprobado en EE.UU., la UE, Israel y Japón para el tratamiento de pacientes adultos con CPNM irresecable o metastásico cuyos tumores presentan mutaciones activadoras de HER2 (ERBB2) 4.
¿Está aprobado Enhertu para el cáncer de pulmón en el Reino Unido?
A partir de julio de 2024, todavía no. Un proyecto de guía final publicado por el NICE en marzo de 2024 anunció que Enhertu no estará en el NHS hasta que se disponga de un precio rentable. Mientras tanto, lamentablemente, Enhertu no está disponible en el Reino Unido para el cáncer de pulmón 7.
¿Puede mi médico recetarme Enhertu para el cáncer de pulmón si aún no está aprobado?
La respuesta corta es sí.
Enhertu ya ha sido aprobado en múltiples países para el tratamiento del CPNM con mutación HER2. Por ello, su médico está autorizado a recetarle el medicamento para esta indicación aunque aún no esté aprobado en su país.
Cuando un médico receta un medicamento para tratar una enfermedad para la que (todavía) no está aprobado, se habla de uso no contemplado. En algunos países puede ser difícil obtener una receta de uso no autorizado, dependiendo de la normativa local y de la disponibilidad. Sin embargo, siempre es posible surtirla utilizando la normativa de importación de pacientes designados.
¿Ha tomado su médico la decisión de recetarle Enhertu para el tratamiento de su cáncer de pulmón? Nuestro equipo deeveryone.org puede ayudarle a acceder al medicamento. Estamos especializados en la obtención y entrega de medicamentos prescritos no aprobados o no disponibles en el país del paciente. Póngase en contacto con nosotros para que podamos ayudarle.
Referencias:
- Stewart, Judith. Enhertu (fam-trastuzumab deruxtecan-nxki) FDA Approval History. Drugs.com, 15 de agosto de 2022.
- Enhertu. Agencia Europea de Medicamentos, consultado el 06 de noviembre de 2023.
- HER2 y el cáncer de pulmón. American Lung Association, consultado el 6 de noviembre de 2023.
- Enhertu demostró respuestas tumorales fuertes y duraderas en cáncer de pulmón avanzado HER2-mutante previamente tratado en el ensayo de fase II DESTINY-Lung02. AstraZeneca, 11 de septiembre de 2023.
- Información del proyecto | Trastuzumab deruxtecan para el tratamiento del cáncer de pulmón no microcítico no escamoso no resecable o metastásico con mutación HER2 después de 1 o más terapias [ID3934] | Guía. NICE, consultado el 6 de noviembre de 2023.
- USPI-DB-04 CDX Actualización FINAL. Daiichi Sankyo, consultado el 6 de noviembre de 2023.
- El NICE británico rechaza Enhertu de Daiichi Sankyopara el cáncer de mama, Pharmaceutical Technology, consultado el 15 de julio de 2024.