La esquiva aprobación de Relyvrio en Europa: cómo saltarse la espera
Última actualización: 14 de mayo de 2024

Puede acceder legalmente a nuevos medicamentos, aunque no estén aprobados en su país.
Más informaciónNOTA: Este artículo se escribió antes de abril de 2024, cuando Amylyx, el fabricante de Relyvrio, anunció que retiraría Relyvrio del mercado. A la luz de este acontecimiento, es poco probable que la EMA apruebe Relyvrio. En su lugar, discuta algunas alternativas a Relyvrio con su médico.
Durante décadas, los pacientes de ELA en Europa no han visto la aprobación de ningún nuevo medicamento. En 2023, Relyvrio supuso un rayo de esperanza para cambiar el panorama del tratamiento de la ELA. Tras obtener la aprobación de la FDA, el medicamento estaba en vías de ser aprobado en Europa, hasta que el CHMP rechazó su solicitud. Dos veces.
Mientras las autoridades médicas se limitan a hacer su trabajo, los pacientes de ELA sufren la frustración de la espera. Ante la falta de opciones terapéuticas en una carrera contrarreloj, algunos han recurrido incluso a mezclar sus propios medicamentos 1.
Hay soluciones mejores que ésta. Aquí tienes todo lo que necesitas saber sobre la aprobación de Relyvrio en Europa. Incluidas las opciones seguras y rápidas que tienes para conseguir el tratamiento rápidamente.
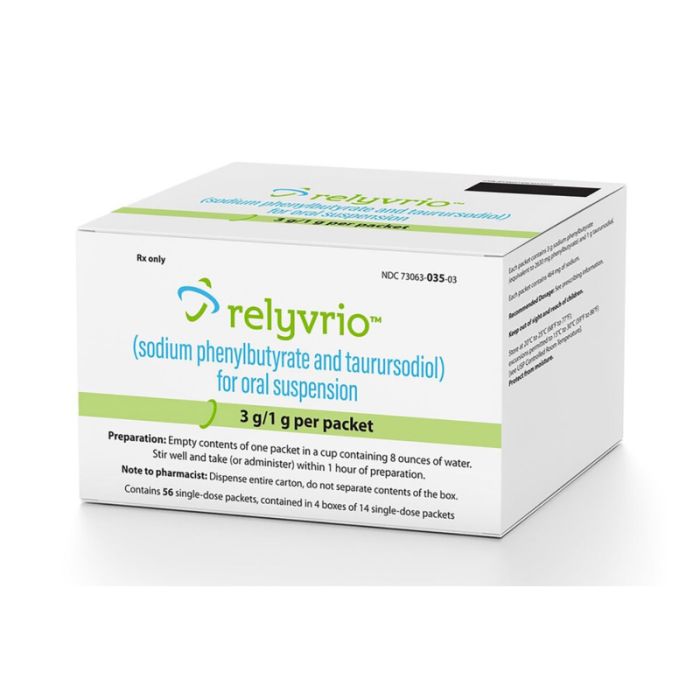
¿Qué hace Relyvrio/Albrioza?
Relyvrio (comercializado en Europa como Albrioza) es un medicamento oral para adultos con ELA. Combina dos principios activos: el taurursodiol y sodium phenylbutyrate. No se conoce bien su mecanismo de acción exacto. Sin embargo, está diseñado para prevenir la muerte de las células nerviosas mediante el bloqueo de las señales de estrés dentro de dos compartimentos celulares (mitocondrias y retículo endoplásmico).
Relyvrio/Albrioza no es una cura para la ELA. Aun así, los resultados de los ensayos clínicos sugieren que puede contribuir a ralentizar la progresión de la enfermedad y ayudar a los pacientes a mantener las funciones físicas durante más tiempo 2.
¿Es eficaz Albrioza/Relyvrio?
La aprobación de Albrioza/Relyvrio por la FDA se basó en los resultados del ensayo clínico CENTAUR. La primera fase del ensayo comparó Relyvrio con placebo para establecer su seguridad y eficacia. La segunda fase del ensayo se centró en la seguridad a largo plazo del tratamiento.
Los resultados clave de este ensayo fueron:
- Relyvrio ralentizó el ritmo de deterioro de la puntuación ALSFRS-R frente a placebo (1,24 puntos frente a 1,66 puntos). Este resultado fue más destacado en las habilidades motoras finas 4;
- El riesgo de muerte fue un 44% menor en los pacientes tratados con Relyvrio que con placebo;
- La mediana de supervivencia fue de 25 meses para el grupo Relyvrio y de 18,5 meses para el grupo de control;
- A los 24 meses del inicio del tratamiento, los pacientes de Relyvrio tenían una probabilidad estimada de supervivencia del 51,6%, frente al 33,9% del grupo placebo 3.
Los resultados del ensayo CENTAUR han sido interpretados positivamente por la FDA, pero el estudio presenta limitaciones. Estas limitaciones han contribuido al rechazo de Relyvrio por la EMA. En la actualidad se está llevando a cabo el ensayo clínico de fase 3 PHOENIX, con la intención de confirmar la eficacia y los beneficios para la supervivencia de Relyvrio. Es de esperar que aporte pruebas adicionales que respalden una nueva solicitud a la EMA. Los resultados del ensayo PHOENIX se esperan para 2024 5.
¿Por qué se denegó a Relyvrio la aprobación de la EMA?
Como paciente, probablemente se pregunte por qué un tratamiento considerado suficientemente eficaz por una agencia es rechazado por otra. Los criterios de aprobación y el rigor de los medicamentos difieren de un país a otro. Y la EMA suele ser una de las agencias más estrictas.
Al rechazar la solicitud de Relyvrio/Albrioza, el CHMP expresó su preocupación por la eficacia del medicamento y la fiabilidad de los datos de los ensayos clínicos. La comisión no estaba convencida de que Albrioza fuera eficaz para ralentizar la progresión de la ELA. Su conclusión fue que no podía establecerse un balance beneficio-riesgo positivo 6.
¿Cuándo estará disponible Relyvrio/Albrioza en Europa?
A pesar de la decepción por el rechazo de la EMA, el fabricante de Albrioza/Relyvrio se ha comprometido a abordar las preocupaciones planteadas por la EMA y volver a solicitar la aprobación. Esperemos que los resultados del ensayo PHOENIX puedan respaldar positivamente esa solicitud.
Normalmente, una solicitud de autorización de comercialización a la EMA tarda unos 210 días en revisarse. Sin embargo, Relyvrio tiene la designación de medicamento huérfano. Esto significa que una posible nueva solicitud con pruebas más sólidas podría ser objeto de una revisión más rápida o de una autorización de comercialización condicional .
En cualquier caso, no parece probable que Relyvrio/Albrioza esté disponible en Europa en 2024.
Cómo conseguir Relyvrio/Albrioza antes de su aprobación por la EMA
En palabras de Sabine Turgeman, directora de la Asociación Francesa para la Investigación de la ELA: "La enfermedad no tiene plazos burocráticos"[1]. Así que, aunque nos encontremos a un año de la aprobación de Relyvrio por la EMA (crucemos los dedos), puede seguir siendo un tiempo frustrantemente largo para los pacientes.
La buena noticia es que no tiene que esperar a que se lo aprueben.
Tiene dos opciones para iniciar el tratamiento con Relyvrio antes de que el medicamento esté disponible en Europa. Una opción es encontrar y participar en un ensayo clínico con Relyvrio/Albrioza. La otra opción es comprar Relyvrio de inmediato como Paciente Nombrado.
He aquí lo que significa cada una de estas opciones.
Únase a un ensayo clínico de Relyvrio
Puede intentar unirse a un ensayo clínico en curso para acceder rápidamente a Relyvrio/Albrioza. Encontrar ensayos no es fácil, pero es posible. Para participar, debe cumplir los criterios de elegibilidad y contar con el apoyo de su médico. Tenga en cuenta que podría recibir un placebo en lugar del principio activo.
Estos son algunos de los lugares donde puede empezar a buscar ensayos clínicos de Relyvrio:
- ClinicalTrials.gov: Se trata de una base de datos con todos los ensayos clínicos de Estados Unidos. Sin embargo, algunos de los ensayos también están abiertos a participantes internacionales. Por el momento, hay un ensayo(NCT05619783) en el que participa Relyvrio y que recluta participantes internacionales por invitación. No obstante, merece la pena estar atento a esta lista, ya que pueden aparecer nuevos ensayos en cualquier momento.
- EUClinicaltrials.eu: Esta base de datos contiene todos los ensayos clínicos de la Unión Europea. Actualmente, contiene información limitada sobre los ensayos iniciados antes del 31 de enero de 2022. Para esos ensayos, puede consultar el Registro de Ensayos Clínicos de la UE.
- myTomorrows y FindMeCure: Estas organizaciones ayudan a los pacientes a encontrar opciones de tratamiento en ensayos clínicos.
Comprar Relyvrio como paciente identificado
Si participar en un ensayo clínico no es una opción para usted, puede comprar Relyvrio/Albrioza inmediatamente como paciente designado. Esto es posible gracias a la normativa de importación de pacientes designados vigente en la mayoría de los países. Para acogerse a esta normativa, necesita una receta de Relyvrio/Albrioza de su médico tratante.
¿Ya tiene una receta? Envíela a nuestro equipo de expertos de Medicine Access y le ayudaremos a comprar Relyvrio inmediatamente. Esté donde esté.
En última instancia, la decisión de acceder a Relyvrio/Albrioza antes de su aprobación por la EMA depende de usted y de su médico. Es esencial abordar este proceso con expectativas realistas y un conocimiento profundo de los posibles riesgos y beneficios que conlleva. Dicho esto, cuando esté listo para iniciar el tratamiento, nuestro equipo está aquí para ayudarle a saltarse la espera.
Referencias:
- Cada mes cuenta: Los pacientes europeos de ELA quieren nuevos fármacos. France 24, 28 de febrero de 2023.
- Por qué RELYVRIO. RELYVRIO.com, consultado el 13 de febrero de 2024.
- Supervivencia a largo plazo de los participantes en el ensayo CENTAUR de sodium phenylbutyrateen la esclerosis lateral amiotrófica. NCBI, consultado el 13 de febrero de 2024.
- Ensayo de Sodium Phenylbutyratepara la esclerosis lateral amiotrófica. The New England Journal of Medicine, 3 de septiembre de 2020.
- Relyvrio para la ELA. ALS News Today, consultado el 13 de febrero de 2024.
- Albrioza | Agencia Europea de Medicamentos. Agencia Europea de Medicamentos, consultado el 13 de febrero de 2024.
- Designación de medicamento huérfano: Visión general | Agencia Europea de Medicamentos. Agencia Europea de Medicamentos, consultado el 13 de febrero de 2024.