Aprobación de Lurbinectedin por la EMA: ¿Vendrá (y cuándo)?
Última actualización: 23 de abril de 2024

Puede acceder legalmente a nuevos medicamentos, aunque no estén aprobados en su país.
Más informaciónLa Lurbinectedin fue designada medicamento huérfano por la FDA y la EMA. También se incluyó en el Proyecto Orbis de la FDA para la aprobación acelerada concurrente de medicamentos oncológicos 6. Todos ellos eran signos de esperanza para los pacientes de cáncer de pulmón microcítico de todo el mundo, lo que sugería la posibilidad de un proceso de aprobación más rápido para el medicamento.
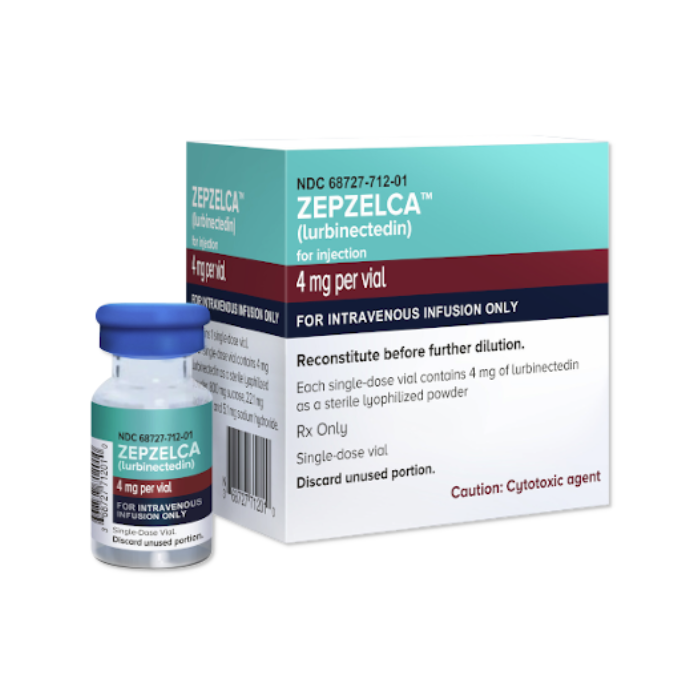
Sin embargo, más de 5 años después de su designación como medicamento huérfano y 3 años después de su aprobación acelerada por la FDA, Zepzelca lurbinectedin) sigue esperando su aprobación por la EMA.
¿Cuánto tiempo tendrán que esperar los pacientes con cáncer de pulmón en Europa y el Reino Unido para acceder a este tratamiento? Infórmese de las últimas noticias, incluidas sus opciones para obtener lurbinectedin antes de que esté ampliamente disponible.
¿Para qué se utiliza lurbinectedin ?
Zepzelca lurbinectedin) es un medicamento de venta con receta para el tratamiento del cáncer de pulmón de células pequeñas (CPCP) metastásico en adultos. Está destinado específicamente a pacientes cuya enfermedad ha progresado después de la quimioterapia 1.
¿Cuál es la tasa de éxito de lurbinectedin?
La FDA concedió a Zepzelca una aprobación acelerada sobre la base del ensayo PM1183-B-005-14. Esto es lo que nos dicen los resultados comunicados sobre la tasa de éxito de lurbinectedin en el CPCP:
-
En el 35% de los pacientes, los tumores se redujeron o desaparecieron;
-
La mediana de la duración de la respuesta fue de 5,3 meses;
-
Algunas de las reacciones adversas más frecuentes fueron leucopenia, linfopenia, fatiga, anemia, neutropenia, aumento de creatinina, alanina aminotransferasa o glucosa 1.
Lurbinectedin ensayos de confirmación
Para mantener su aprobación por la FDA, el fabricante de lurbinectedin tuvo que realizar un estudio de confirmación. Este estudio de fase 3, denominado ATLANTIS, no logró demostrar una mejora estadísticamente significativa de la supervivencia global en comparación con la quimioterapia sola.
Sin embargo, este resultado puede haberse debido al diseño del estudio. Por ejemplo, se probó una dosis de lurbinectedin inferior a la aprobada y se combinó con un agente quimioterápico. Teniendo esto en cuenta, la FDA ha decidido mantener la aprobación de Zepzelca. Para confirmar su eficacia, el fabricante deberá aportar datos de un nuevo ensayo confirmatorio con un diseño adecuado.
En la actualidad se están llevando a cabo dos ensayos de confirmación de la lurbinectedin . El ensayo LAGOON finalizará en junio de 2025, y el ensayo IMForte concluirá en marzo de 2026. Es de esperar que los datos de estos ensayos respalden la aprobación prolongada del medicamento en EE.UU. y ayuden a acelerar su aprobación en otras regiones, como Europa.
Aprobación de Lurbinectedin por la EMA: ¿Cuál es la situación?
En 2019, la EMA concedió a lurbinectedin la designación de medicamento huérfano para tratar el CPCP 2. Sin embargo, desde entonces no se ha presentado a la EMA ninguna solicitud formal de autorización de comercialización.
Normalmente, desde el momento en que se presenta una solicitud de autorización de comercialización pasan hasta 210 días hasta que se toma una decisión de aprobación. Este proceso puede ser un poco más rápido para los medicamentos huérfanos. En cualquier caso, incluso si PharmaMar presentara hoy su solicitud de autorización a la EMA, la aprobación no se produciría antes de finales de 2024 o principios de 2025.
Una excepción a este calendario es Suiza, donde el medicamento recibió la aprobación temporal en marzo de 2023 4.
¿Cuándo estará disponible lurbinectedin en Europa?
Es difícil saberlo. Si se presenta una solicitud de aprobación de la EMA para lurbinectedin antes de finales de año, a mediados de 2025 podría haber teóricamente una decisión al respecto. De ser positiva, la aprobación de Zepzelca por la EMA tardaría otros 67 días en hacerse oficial.
A partir de ese momento, cada Estado miembro de la UE puede iniciar sus propios procedimientos de negociación de precios locales, reembolso y lanzamiento al mercado local. La duración de estos procedimientos depende de cada país.
Alemania tiende a ser el país más rápido en lanzar nuevos medicamentos huérfanos aprobados, con una media de 102 días. En el extremo opuesto se encuentra Estonia, donde se tarda una media de 1.081 días en comercializar un nuevo medicamento huérfano 3.
En otras palabras, parece que lurbinectedin estará disponible en la UE no antes de finales de 2025 o principios de 2026.
¿Cuándo estará disponible Zepzelca en el Reino Unido?
La MHRA concedió a Zepzelca la designación de medicamento innovador en 2022. Ese mismo año, PharmaMar presentó una solicitud formal de autorización condicional de comercialización en el Reino Unido 5.
Sin embargo, desde entonces no se ha tomado ninguna decisión. En abril de 2024, la MHRA aún no había aprobado lurbinectedin. El NICE también ha suspendido su evaluación del medicamento para su posible inclusión en el NHS. Ninguna de las dos agencias ha facilitado un calendario de decisiones.
Cómo obtener lurbinectedin de forma segura antes de su aprobación por la MHRA y la EMA
¿Es usted paciente de CPCP? Si su médico opina que usted podría beneficiarse del tratamiento con Zepzelca, es posible que no tenga que esperar a su aprobación en Europa o el Reino Unido. En su lugar, su médico y usted podrían considerar la posibilidad de participar en un ensayo clínico lurbinectedin . O bien, adquirir el medicamento a título individual.
Únase a un ensayo clínico lurbinectedin
Una forma de acceder a Zepzelca lurbinectedin) es inscribirse en un ensayo clínico. A menudo es más fácil decirlo que hacerlo, ya que usted y su médico tendrán que encontrar un ensayo que esté reclutando participantes en su país. También tendrá que cumplir sus criterios de elegibilidad. Para todo esto, necesitará el apoyo de su médico tratante.
A continuación se indican algunos buenos lugares para empezar a buscar ensayos clínicos lurbinectedin en curso:
-
ClinicalTrials.gov: Se trata de una base de datos con todos los ensayos clínicos de Estados Unidos. Algunos de los ensayos también están abiertos a participantes internacionales. Un ejemplo es el ensayo clínico LAGOON. Es estadounidense, pero también está abierto a pacientes de Europa y Asia.
-
EUClinicaltrials.eu: Se trata de una base de datos con todos los ensayos clínicos de la Unión Europea. Actualmente, contiene información limitada sobre los ensayos iniciados antes del 31 de enero de 2022. Para esos ensayos, puede consultar el Registro de Ensayos Clínicos de la UE.
-
myTomorrows: Esta organización ayuda a los pacientes a encontrar opciones de tratamiento en ensayos clínicos.
Comprar lurbinectedin como paciente designado
En la mayoría de los países, se permite a los pacientes comprar e importar medicamentos que puedan mejorar su calidad de vida o tratar enfermedades potencialmente mortales. Si desea acceder a Zepzelca antes de que esté disponible en su país, esta podría ser la opción más rápida para usted y su médico.
La normativa que lo hace posible se conoce como Reglamento de Importación de Pacientes Individuales Nombrados. Puede haber variaciones entre países en cuanto a los requisitos administrativos específicos. No obstante, en todos los casos deben cumplirse estos criterios:
-
El medicamento en cuestión está autorizado en otro país y (aún) no está autorizado o disponible en el país del paciente;
-
No hay alternativa en el mercado local;
-
El medicamento es para uso personal;
-
El paciente tiene una carta de prescripción de su médico tratante;
-
El médico asume la responsabilidad del tratamiento. Esto puede requerir una documentación diferente de un país a otro.
¿Desea acogerse a la normativa de importación individualizada de pacientes para obtener lurbinectedin antes de su aprobación en la UE? Primero tendrá que consultar a su médico tratante y obtener una receta adecuada.
¿Ya tiene receta? Nuestro equipo puede ayudarle a acceder a Zepzelca. Estamos especializados en la obtención y entrega de medicamentos que aún no están disponibles en su país. Póngase en contacto con nosotros para obtener más información.
Referencias:
- ID de referencia: 4624945. Accessdata.fda.gov, consultado el 23 de abril de 2024.
- EU/3/19/2143 - designación huérfana para el tratamiento del cáncer de pulmón de células pequeñas. Agencia Europea de Medicamentos, 9 de abril de 2019.
- EFPIA Patients W.A.I.T. Indicator 2021 Survey. Efpia, consultado el 23 de abril de 2024.
- PharmaMar anuncia la aprobación de Zepzelca® (lurbinectedin) para el tratamiento del cáncer de pulmón microcítico metastásico en Suiza. Pharmamar, consultado el 23 de abril de 2024.
- PharmaMar ha solicitado la aprobación de lurbinectedin para el tratamiento del cáncer de pulmón microcítico metastásico en el Reino Unido. Pharmamar, consultado el 23 de abril de 2024.
- Proyecto Orbis. FDA, consultado el 23 de abril de 2024.