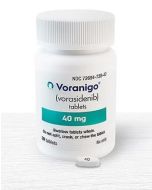
Aprobación del vorasidenib por la EMA: ¿Cuándo estará disponible en Europa, el Reino Unido y el resto del mundo?
Última actualización: 19 de agosto de 2024
Puede acceder legalmente a nuevos medicamentos, aunque no estén aprobados en su país.
Más informaciónLos gliomas de bajo grado suelen aparecer en personas sanas de entre 30 y 40 años. Al principio crecen lentamente, pero con el tiempo pueden convertirse en tumores de alto grado que requieren tratamientos más agresivos 1.
El vorasidenib, el primer tratamiento dirigido para gliomas de bajo grado, está recibiendo una gran atención. Los datos de los ensayos clínicos indican que puede retrasar la progresión del tumor en gliomas de bajo grado con mutaciones en IDH1 o IDH2, lo que podría cambiar la vida de los pacientes con glioma 1.
Si usted también desea conocer las últimas novedades sobre este nuevo avance en el tratamiento del cáncer cerebral, siga leyendo. Veremos cuándo es probable que el vorasidenib obtenga la aprobación de la EMA, así como cuándo estará disponible en Europa, el Reino Unido y otros países.
¿Cómo actúa vorasidenib contra el cáncer cerebral?
Voranigo (vorasidenib) es una terapia dirigida contra el cáncer cerebral que aborda específicamente los gliomas con una mutación IDH, los tumores cerebrales malignos primarios más frecuentes en personas menores de 50 años 2. Casi todos los gliomas de grado 2, incluidos los astrocitomas y los oligodendrogliomas, presentan esta mutación.
Los tratamientos actuales -cirugía, radioterapia y quimioterapia- son muy tóxicos y tienen importantes efectos secundarios. El vorasidenib ofrece una alternativa crucial al atacar las enzimas IDH1 e IDH2 mutadas, con el objetivo de frenar el crecimiento tumoral.
¿Cuál es la eficacia de vorasidenib en los ensayos clínicos?
En noviembre de 2023, se presentaron los datos del ensayo de fase 3 INDIGO. Estos datos se convirtieron en la base de la solicitud de aprobación de la FDA que presentó el fabricante de vorasidenib en febrero de 2024 3.
He aquí algunos informes clave del ensayo INDIGO:
- La mediana de supervivencia sin progresión fue de 27,7 meses para los pacientes con vorasidenib frente a 11,1 meses para el grupo placebo;
- Vorasidenib produjo una reducción del 61% en el riesgo de progresión tumoral o muerte;
- Los pacientes tratados con vorasidenib tenían un 83,4% de probabilidad de NO recibir otra intervención terapéutica en 24 meses. La probabilidad de que los pacientes tratados con placebo no necesitaran una intervención fue del 27% 4,5.
Estos resultados son un rayo de esperanza para los pacientes de glioma de bajo grado de todo el mundo. Pero, ¿cuándo se convertirán los resultados de los ensayos clínicos en aprobaciones de vorasidenib? Y después de la aprobación, ¿cuánto tiempo pasará hasta que el medicamento esté disponible en todo el mundo?
¿Está aprobado el vorasidenib en algún sitio?
Sí, en agosto de 2024, la FDA concedió a Voranigo (vorasidenib) una aprobación acelerada en Estados Unidos. Además, las solicitudes de aprobación de Vorasidenib están siendo revisadas en:
- 6. La UE (con evaluación acelerada)
- Canadá 7.
¿Cuándo obtendrá vorasidenib la aprobación de la EMA?
El plazo previsto por la EMA para las evaluaciones aceleradas es de 150 días. Sin embargo, esto presupone que la EMA tome una decisión antes de finales de junio de 2024, lo que no ha sucedido. Tal retraso no es inusual. Los plazos de aprobación pueden variar si la EMA necesita datos adicionales del fabricante. Tras la reciente aprobación del vorasidenib por la FDA, es probable que la aprobación de la EMA no esté muy lejos. Sin embargo, sólo el tiempo dirá cuándo podrán beneficiarse del tratamiento los pacientes de la UE.
¿Cuándo estará disponible el vorasidenib en Europa?
Por desgracia, obtener la aprobación de la EMA es sólo el primer paso. No significa que el vorasidenib vaya a estar disponible inmediatamente para los pacientes de toda la UE. Tras la aprobación de la EMA, cada Estado miembro tarda un tiempo diferente en negociar los precios locales, los reembolsos y el lanzamiento de un nuevo medicamento en el mercado local.
El proceso de lanzamiento de Alemania tiende a ser el más rápido, con una media de 102 días para los medicamentos huérfanos. En el extremo opuesto se encuentra Estonia, donde un nuevo medicamento puede tardar hasta 1.081 días de media en estar disponible.
Esto significa que vorasidenib estará disponible en un momento diferente, dependiendo del lugar de Europa en el que se encuentre .
¿Cuándo se aprobará Voranigo (vorasidenib) en el Reino Unido?
Eso es más difícil de decir. A partir de agosto de 2024, no se ha presentado ninguna autorización de comercialización a la MHRA para el vorasidenib. Sin embargo, según la normativa posterior al Brexit, la MHRA puede decidir aprobar medicamentos a nivel local en cuanto obtengan luz verde de otro organismo regulador de confianza (como la EMA o la FDA). Es lo que se conoce como Procedimiento de Dependencia Internacional 9. No sería de extrañar que la MHRA decidiera tomar este camino para aprobar el vorasidenib, teniendo en cuenta la necesidad de tratamiento no cubierta para los pacientes con gliomas de bajo grado en el Reino Unido.
¿Cuándo estará disponible vorasidenib en el Reino Unido?
Si la MHRA aprueba el vorasidenib simultáneamente con la FDA o la EMA, el medicamento requerirá una evaluación del NICE antes de estar disponible para los pacientes en el Reino Unido. El NICE decidirá si el vorasidenib debe estar disponible en el NHS. Si se aprueba, el vorasidenib deberá estar disponible para los pacientes del Reino Unido en un plazo de tres meses a partir de la fecha de la decisión.
Aunque el NICE ha iniciado una evaluación, no se ha anunciado una fecha para la decisión 10. Suponiendo el mejor de los casos, en el que la MHRA sigue la aprobación de vorasidenib por la FDA en agosto de 2024, y el NICE toma una decisión positiva poco después, vorasidenib podría estar disponible en el Reino Unido a finales de 2024 o principios de 2025.
Los pacientes cuyo tratamiento no pueda esperar hasta entonces, podrán acceder a vorasidenib en el Reino Unido a través de un programa de uso compasivo 11.
¿Cómo conseguir vorasidenib antes de que esté disponible en su país?
A pesar de lo que sugieren los plazos mencionados, esperar no es la única opción para los pacientes con glioma de bajo grado en Europa, el Reino Unido o cualquier otro lugar.
Ahora que Voranigo (vorasidenib) cuenta con su primera aprobación mundial en EE.UU., puede acceder inmediatamente al medicamento en cualquier otro lugar importándolo para su uso personal. Esta opción se conoce como Importación de pacientes designados, o acceso ampliado. Así es como funciona.
Acceso ampliado a vorasidenib
Aunque un medicamento aún no esté aprobado o disponible en su país, puede acceder a él legalmente. Una normativa conocida como Importación de Pacientes Designados le permite comprar e importar un medicamento, siempre que cumpla estas condiciones:
- está aprobado en alguna parte;
- no está aprobado ni disponible en su país (todavía);
- no tiene alternativas locales, y
- es para uso personal.
Este proceso requiere la prescripción de su médico tratante. Como en todos los demás casos, el médico asume la responsabilidad del tratamiento. Los requisitos específicos de documentación pueden variar según el país.
¿Desea iniciar su tratamiento con vorasidenib lo antes posible, acogiéndose a la normativa de Importación de Pacientes Designados? Primero deberá consultar a su médico tratante y obtener una receta adecuada.
¿Ya tiene una receta? Compártala con nuestro equipo en Everyone.org. Podemos ayudarle a comprar vorasidenib en cuanto se apruebe en algún lugar del mundo.
Referencias:
- El vorasidenib es eficaz contra los gliomas de bajo grado. Instituto Nacional del Cáncer, 27 de junio de 2023.
- Passey, J. Un ensayo clínico reciente sugiere que el fármaco vorasidenib podría ofrecer una nueva opción de tratamiento para el glioma de bajo grado. The Brain Tumour Charity, 30 de junio de 2023.
- La FDA y la EMA aceptan la presentación del vorasidenib para el glioma difuso con mutación IDH. OncLive, 20 de febrero de 2024.
- INDIGO: Vorasidenib ofrece a los pacientes con glioma de bajo grado con mutación IDH un medio para retrasar la quimioterapia y la radioterapia. ASCO Daily News, consultado el 27 de mayo de 2024.
- Vorasidenib en el glioma de bajo grado con mutación IDH1 o IDH2. The New England Journal of Medicine, 4 de junio de 2023.
- La FDA y la EMA aceptan las solicitudes de autorización de vorasidenib para el tratamiento del glioma difuso con mutación IDH. Duke Research & Innovation, 21 de febrero de 2024.
- Solicitudes de medicamentos y productos sanitarios en proceso de revisión. Health Canada, consultado el 27 de mayo de 2024.
- EFPIA Patients W.A.I.T. Indicator 2021 Survey. Consultado el 27 de mayo de 2024.
- Fast-Tracking Approval of Medicines - UK Publishes Detailed Guidance on its New International Recognition Procedure. Inside EU Life Sciences, 11 de septiembre de 2023.
- Información del proyecto | Vorasidenib para el tratamiento del astrocitoma u oligodendroglioma con mutaciones IDH1 o IDH2 después de la cirugía en personas de 12 años o más TS ID 11974. NICE, consultado el 28 de mayo de 2024.
- Actualización sobre vorasidenib para la comunidad de tumores cerebrales del Reino Unido. Brain Tumour Research, consultado el 28 de mayo de 2024.